Una cèl·lula seca és la forma més senzilla de produir electricitat. Un nombre de cel·les combinades formen una bateria. El àcid de plom o níquel-cadmi pila és la versió avançada de la cèl·lula seca. Aquesta cèl·lula va ser inventada per primera vegada per l'enginyer francès Georges Leclanche l'any 1866. La seva invenció va rebre el nom del seu nom de bateria Leclanche. Però en aquell moment era molt pesat i es podia trencar fàcilment. Una cèl·lula seca té el mateix principi i és la versió avançada de la bateria Leclanche i té diferents voltatges i mides. La forma comercial de la cèl·lula de zinc-carboni que és la forma modificada de la bateria de Leclanche va ser inventada el 1881 per Carl Gassner de Mainz. Es produeix en grans quantitats i s'utilitza en moltes aplicacions com joguines, ràdios, calculadores, etc.
Què és una cèl·lula seca?
Una cèl·lula seca és un dispositiu que genera electricitat a partir de reaccions químiques. Quan els dos elèctrodes de la cèl·lula es connecten mitjançant un camí tancat, la cèl·lula obliga els electrons a fluir d’un extrem a l’altre. El flux d’electrons fa que el corrent flueixi al circuit tancat.

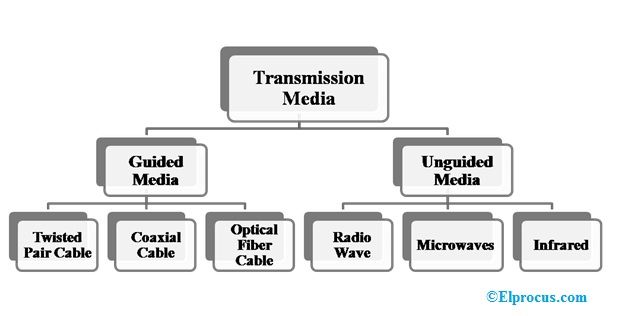
Capes de cèl·lules seques
Amb l’ajut de reaccions químiques, els electrons flueixen d’un extrem a l’altre. Quan dues o més cèl·lules, connectades amb la polaritat correcta, flueixen més electrons a causa de l’alt potencial. Aquesta combinació s’anomena bateria. Des d’un voltatge mínim d’1,5 V fins a 100 V, es pot utilitzar una bateria per obtenir un rang de tensions. Fins i tot el voltatge CC de sortida de la bateria es pot regular a diferents nivells mitjançant convertidors electrònics de potència com picador circuits.
Estructura de la cèl·lula
A la figura es mostra l’estructura de la cèl·lula seca de carboni-zinc. Consisteix en el terminal de l'ànode com a vareta de zinc o, en general, de grafit. El carboni forma el terminal del càtode. Es pot observar que en versions antigues de cèl·lules seques el zinc es feia servir com a càtode i el grafit com a terminal ànode. La selecció dels elements es basa fonamentalment en la seva configuració química de l'òrbita més externa dels elements.

Estructura de cèl·lules seques
Si té més nombre d'electrons a l'òrbita més externa, pot actuar com a donant i, per tant, forma el càtode. De la mateixa manera, si l'òrbita més externa té menys electrons, pot acceptar fàcilment i, per tant, formar l'ànode. L'electròlit col·locat entre si actua com a catalitzador de les reaccions químiques. En general, fem servir gelea de clorur d’amoni com a electròlit. A la figura que es mostra, l’electròlit utilitzat és una barreja de zinc i clorur. A més, el clorur de sodi també s’utilitza com a electròlit. Al voltant de la vareta de l’ànode s’envolta una barreja de diòxid de manganès i carboni.
Tota la configuració es col·loca en un tub metàl·lic. S'evita que la gelea s'assequi mitjançant un to a la part superior de la cèl·lula. Es col·loca una rentadora de carboni a la part inferior. L’objectiu d’aquesta rentadora és evitar que la vareta de l’ànode de zinc entri en contacte amb el contenidor.
Això també s’anomena espaiador com es mostra al diagrama. La llauna de zinc també està envoltada per aïllament de paper per a aïllaments. Per a bateries grans, també s’utilitzen altres materials aïllants com la mica, etc. El terminal positiu de l’ell es forma a la part superior. El terminal negatiu de la cèl·lula es forma a la base.
Funcionament de la cèl·lula seca
Una cèl·lula seca treballa fonamentalment en les reaccions químiques. A causa de les reaccions que tenen lloc entre l’electròlit i els elèctrodes, els electrons flueixen d’un elèctrode a l’altre. Substàncies com els àcids es dissolen a l’aigua per formar partícules ionitzades. La partícula ionitzada és de dos tipus. Els ions positius s’anomenen cations i els ions negatius s’anomenen anions. Els àcids que es dissolen a l’aigua s’anomenen electròlits.
Al diagrama esmentat anteriorment, el clorur de zinc es forma com l’electròlit. De manera similar, la gelea de clorur d'amoni també es forma com a electròlit. Les barres metàl·liques immerses en electròlits formen elèctrodes. Basant-nos en les característiques químiques de les barres metàl·liques, tenim un elèctrode positiu com a ànode i un elèctrode negatiu com a càtode.
Els elèctrodes atrauen els ions carregats oposadament cap al seu costat. Per exemple, el càtode atrau els anions i l’ànode atrau els cations. En aquest procés, els electrons flueixen d'una direcció a l'altra, de manera que obtenim un flux de càrregues. Això es diu actual .
Reaccions químiques
Les reaccions que tenen lloc a la cèl·lula es mostren a continuació. El primer és la reacció d’oxidació.

En això, el càtode de zinc s’oxida a ions de zinc carregats positivament alliberant dos ions. Aquests electrons són recollits per l’ànode. Després ve la reacció de reducció.

La reacció de reducció a l’ànode es mostra més amunt. Aquesta reacció produeix un corrent elèctric. Allibera ions òxid amb òxid de magnesi. Aquesta reacció es forma quan el magnesi es combina amb l'electròlit.


Les altres dues reaccions representen una reacció àcid-base i una reacció de precipitació que té lloc a la cèl·lula seca. En la reacció àcid-base, el NH es combina amb OH per produir NH3 juntament amb aigua. Els resultats són NH3 i base d’aigua.
Diferència entre una cèl·lula seca i una cèl·lula humida
La principal diferència entre la cèl·lula seca i la cèl·lula humida és la forma d’electròlit. Com s'ha comentat anteriorment, en una cel·la seca, l'electròlit, com el clorur d'amoni, té una naturalesa seca. Aquestes cèl·lules seques són més freqüents i s'utilitzen en joguines, ràdios, etc. Però en una cèl·lula humida, l'electròlit es troba en estat líquid.
S’utilitzen electròlits líquids com l’àcid sulfúric, que és un líquid corrosiu perillós. A causa de la naturalesa d’aquests líquids, la cèl·lula humida té una naturalesa més explosiva i s’ha de manipular amb cura. El millor avantatge d’aquestes cèl·lules humides és que es poden recarregar fàcilment i utilitzar-se per a nombroses aplicacions. Aquestes bateries tenen un ús comú a l’aviació, els serveis públics, l’emmagatzematge d’energia i les torres de telefonia mòbil.
Funcions de cèl·lules seques
La funció de la cèl·lula seca es basa en les reaccions químiques entre l'elèctrode i els electròlits. Quan els elèctrodes es col·loquen en els electròlits, atrau els ions carregats oposadament cap a si mateixos. Això provoca el flux de càrregues i, per tant, es produeix corrent.
Avantatges
El avantatges de la cèl·lula seca inclou el següent.
- La cèl·lula seca té nombrosos avantatges, com ara
- És de mida petita.
- Pot presentar diversos nivells de tensió.
- És útil i té nombroses aplicacions.
- És l’única font de tensió de corrent continu.
- Es pot utilitzar juntament amb circuits electrònics de potència per regular la tensió de sortida
- És recarregable.
Desavantatges
El desavantatges de la cèl·lula seca inclou el següent.
- S’ha de manipular amb cura
- És explosiu
- Les bateries grans són molt pesades
Aplicacions
El aplicacions de la cèl·lula seca inclou el següent.
- Joguines
- Aviació
- Telèfon mòbil
- ràdio
- Calculadora
- Rellotges
- Audiòfons
Per tant, hem vist el funcionament, la classificació i les aplicacions del cèl·lules seques . Un punt interessant a destacar és que la bateria només funciona quan els elèctrodes estan físicament en contacte entre ells. Hi ha d’haver un medi conductor entre els dos elèctrodes. La pregunta és que es pot utilitzar l'aigua com a medi conductor entre els elèctrodes de la cèl·lula seca? En aquest cas, què passarà si aquesta cèl·lula es submergeix en aigua?