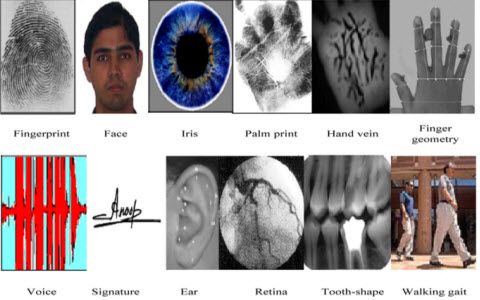
La disposició de les molècules en sòlids, líquids , i els gasos no són el mateix. En els sòlids, es disposen de manera que els electrons dels àtoms de la molècula es desplacin cap als àtoms veïns orbitals. En els gasos, la disposició de les molècules no és propera, mentre que en els líquids és moderada. Per tant, l’orbital d’electrons es cobreix parcialment quan els àtoms s’acosten mútuament. A causa de la combinació d’àtoms dins dels sòlids, com a alternativa als nivells d’energia individuals, es formen els nivells de bandes d’energia. El conjunt de nivells d’energia s’omple de prop, el que es coneix com a banda d’energia.
Què és Energy Band?
La definició de banda d’energia és el nombre d’àtoms que hi ha una pedra de cristall poden estar més a prop l’un de l’altre i un nombre d’electrons interactuaran entre ells. Els nivells d'energia dels electrons dins de la seva capa poden ser causats a causa dels canvis en els seus nivells d'energia. La principal característica de l’energia banda és que els estats energètics de l’electrònica de l’electró són estables en diferents rangs. Per tant, el nivell d’energia d’un àtom canviarà a les bandes de conducció i de valència.
Teoria de les bandes energètiques
Segons la teoria de Bohr, cada closca d’un àtom inclou una quantitat d’energia separada a nivells diferents. Aquesta teoria dóna principalment detalls sobre el comunicació d’electrons entre la closca interior i la closca exterior. Segons la teoria de la banda d’energia, les bandes d’energia es classifiquen en tres tipus que inclouen els següents.

teoria de bandes d'energia
- Banda de Valence
- Bretxa energètica prohibida
- Banda de conducció
Valance Band
El flux d'electrons dins dels àtoms en nivells fixos d'energia, però l'energia de l'electró a la capa interna és superior a la capa externa dels electrons. Els electrons que són presents a l'interior de la carcassa es denominen electrons de valance.
Aquests electrons inclouen una seqüència de nivells d'energia que formen una banda d'energia anomenada banda de valència. Aquesta banda inclou la màxima energia ocupada.
Banda de conducció
Els electrons de valència s’uneixen lliurement cap al nucli a temperatura ambient. Alguns dels electrons dels electrons de valència abandonaran la banda lliurement. Per tant, s’anomenen electrons lliures perquè flueixen cap als àtoms veïns.
Aquests electrons lliures conduiran el flux de corrent dins d’un conductor que es coneix com electrons de conducció. La banda que inclou electrons s’anomena banda de conducció i l’energia ocupada d’aquesta serà menor.
Forbidden Gap
La bretxa prohibida és la bretxa entre la banda de conducció i la banda de valència. Aquesta banda està prohibida sense energia. Per tant, no hi ha flux d'electrons en aquesta banda. El flux d’electrons de la valència a la conducció passarà per aquest buit.
Si aquest buit és més gran, els electrons de la banda de valència estan fortament units cap al nucli. Actualment, per expulsar els electrons d’aquesta banda, és necessària una mica de força exterior, que equival a la bretxa d’energia prohibida. A l'esquema següent, a continuació es mostren les dues bandes, així com un buit prohibit. En funció de la mida de la bretxa, semiconductors , es formen conductors i aïllants.
Tipus de bandes energètiques
Les bandes d'energia es classifiquen en tres tipus, a saber
- Aïllants
- Semiconductors
- Conductors
Aïllants
Els millors exemples d’aïllant són la fusta i el vidre. Aquests aïllants no ho permeten flux d'electricitat per fluir a través d’ells. Els aïllants tenen una conductivitat i una resistivitat extremadament baixes. A l’aïllant, la bretxa energètica és extremadament elevada, és a dir, 7eV. El material no pot funcionar perquè el flux d’electrons de les bandes fa que la valència a la conducció sigui inviable.

aïllants de banda d'energia
Les principals característiques dels aïllants inclouen principalment la bretxa energètica, ja que la prohibició és extremadament gran. Per a alguns tipus d’aïllants, quan augmenta la temperatura, poden il·lustrar alguna transmissió.
Semiconductors
Els millors exemples de semiconductors són el silici (Si) i el germani (Ge), que són els materials més utilitzats. Les propietats elèctriques d’aquests materials es troben entre els semiconductors i els aïllants. Les imatges següents mostren el diagrama de la banda d’energia del semiconductor allà on la banda de conducció pot quedar vacant i la banda de valència està totalment omplerta, tot i que el buit prohibit entre aquestes bandes és minut, és a dir, 1eV. El buit prohibit de Ge és de 0,72eV i Si és de 1,1eV. Per tant, el semiconductor necessita poca conductivitat.

banda d'energia en semiconductors
Les principals característiques dels semiconductors inclouen principalment la bretxa energètica, ja que la prohibició és extremadament petita. Quan la temperatura del semiconductor augmenta, la conductivitat disminuirà.
Conductors
El conductor és un tipus de material on la bretxa d'energia prohibida s'esvaeix a mesura que la banda de valència i la banda de conducció es converteixen en extremadament propers que parcialment cobreixen. Els millors exemples de conductors són l’or, l’alumini, el coure i l’or. La disponibilitat d’electrons lliures a temperatura ambient és enorme. A continuació es mostra el diagrama de la banda d’energia del conductor.

conductors de banda d'energia
Les principals característiques dels conductors inclouen principalment la bretxa energètica, ja que prohibida no existirà. Les bandes energètiques com la protecció i la conducció es superposaran. La disponibilitat d’electrons lliures per a la conducció és àmplia. La conducció augmentarà un cop augmenti el petit nombre de voltatge.
Per tant, es tracta d’una visió general de la banda d'energia . A partir de la informació anterior, podem concloure que la disposició de la molècula en substàncies com sòlids, líquids i gasos és diferent. En els gasos, les molècules no estan a prop, en els sòlids les molècules estan disposades molt de prop i en els líquids, les molècules estan disposades de forma moderada. Per tant, els electrons dins dels àtoms de la molècula tendeixen a fluir cap als orbitals dels àtoms adjacents. Per tant, l’orbital d’electrons es cobreix parcialment mentre els àtoms s’acosten de manera conjunta. A causa de la barreja d’àtoms dins dels sòlids, com a substitut només dels nivells d’energia, es formaran les bandes d’energia. Aquests s’embalen de prop i s’anomenen bandes d’energia. Aquí teniu una pregunta, banda d’energia en sòlids?