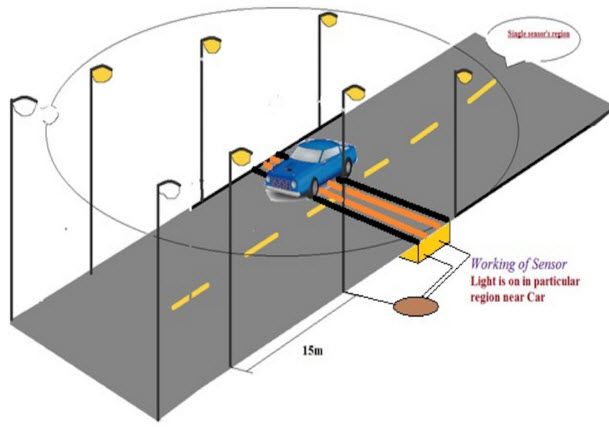
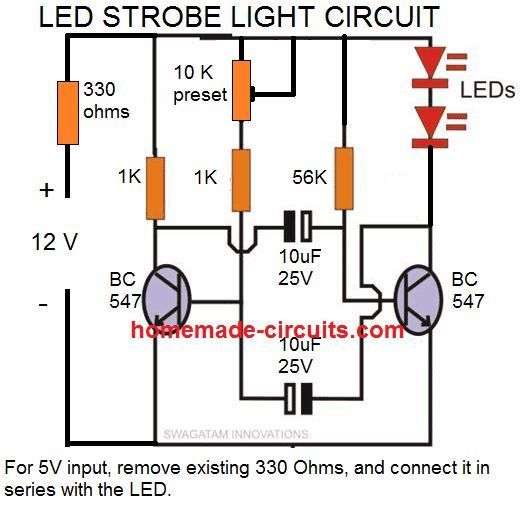
Les bateries són la font d’alimentació més comuna per a dispositius de mà bàsics per a aplicacions industrials a gran escala. Es pot definir una bateria ja que és una combinació d’una o més cèl·lules electroquímiques capaces de convertir l’energia química emmagatzemada en energia elèctrica.

Funcionament de la bateria:
Una bateria és un dispositiu que consisteix en diverses cel·les voltaiques. Cada cel·la voltaica està formada per dues mitges cel·les connectades en sèrie per un electròlit conductor que conté anions i ions de gats. Una mitja cel·la inclou l’electròlit i l’elèctrode al qual es mouen els anions, és a dir, l’ànode o elèctrode negatiu i l’altra mitja cel·la inclou l’electròlit i l’elèctrode al qual es mouen els ions dels gats, és a dir, el càtode o elèctrode positiu.
En la reacció redox que alimenta la bateria, es produeix una reducció dels cations al càtode, mentre que l’oxió es produeix als anions de l’ànode. Els elèctrodes no es toquen els uns als altres, sinó que estan connectats elèctricament per l’electròlit. Majoritàriament, les mitges cèl·lules tenen electròlits diferents. Totes les coses considerades a cada mitja cèl·lula estan tancades en un recipient i un separador que és porós als ions, però no la major part dels electròlits impedeixen la barreja.

Funcionament de la bateria
Cada mitja cèl·lula té una força electromotriu (Emf), determinada per la seva capacitat per conduir corrent elèctric des de l'interior cap a l'exterior de la cèl·lula. L’emf net de la cèl·lula és la diferència entre l’emf de les seves mitges cel·les. D’aquesta manera, si els elèctrodes tenen emf i, en altres paraules, l’emf net és la diferència entre els potencials de reducció de les semirreaccions.
Com es manté la bateria?
Per mantenir la bateria en bon estat, és necessària una igualació de la bateria. A causa de l'envelliment, totes les cèl·lules no es carreguen de manera similar i algunes cèl·lules accepten la càrrega extremadament ràpida mentre que d'altres es carreguen gradualment. La igualació es pot fer carregant marginalment la bateria per permetre que les cèl·lules més febles també es carreguin completament. La tensió del terminal d’una bateria completament carregada és de 12V, la bateria de l’automòbil mostra 13,8V als seus terminals, mentre que la bateria tubular de 12 volts mostrarà 14,8V. La bateria de l’automòbil s’ha de fixar fermament al vehicle per evitar sacsejades. Si és possible, s’ha de col·locar la bateria de l’inversor sobre un tauló de fusta.
2 tipus de bateries
1) Bateries primàries:
Com el seu nom indica, aquestes bateries estan destinades a un sol ús. Un cop s'utilitzen aquestes bateries, no es podran recarregar, ja que els dispositius no són reversibles fàcilment i és possible que els materials actius no tornin a les seves formes originals. Els fabricants de bateries recomanen la recàrrega de les cel·les primàries.
Alguns exemples de les bateries d’un sol ús són les bateries AA, AAA normals que fem servir en rellotges de paret, comandaments per a televisors, etc. Un altre nom d’aquestes bateries són les bateries d’un sol ús.

Tipus de bateria
2) Bateries secundàries:
Les bateries secundàries també s’anomenen bateries recarregables. Aquestes bateries es poden utilitzar i recarregar simultàniament. Normalment es munten amb materials actius amb actius en estat descarregat. Les bateries recarregables es recarreguen aplicant corrent elèctric, que inverteix les reaccions químiques que es produeixen durant la descàrrega. Els carregadors són dispositius que subministren el corrent requerit.
Alguns exemples d’aquestes bateries recarregables són les bateries que s’utilitzen en telèfons mòbils, reproductors MP3, etc. Els dispositius com els audiòfons i els rellotges de polsera utilitzen cel·les en miniatura i, en llocs com les centrals telefòniques o els centres de dades d’ordinadors, s’utilitzen bateries més grans.

Bateries secundàries
Tipus de bateries secundàries (recarregables):
SMF, plom àcid, Li i Nicd
Bateria SMF:
SMF és un bateria segura sense manteniment, dissenyada per oferir una fiabilitat, coherència i poca energia de manteniment per a aplicacions de SAI. Aquestes bateries poden estar subjectes a aplicacions de cicle profund i un manteniment mínim a les zones rurals i amb dèficit d'energia. Aquestes bateries estan disponibles a partir de 12V.
Al món informatiu actual, no es pot passar per alt el requisit que els sistemes de bateries estiguin dissenyats per recuperar dades i informació qualificades crucials i executar instruments bàsics per a la durada desitjada. Es necessiten bateries per subministrar energia instantània. Les bateries poc fiables i inferiors poden provocar la pèrdua d’aturades de dades i equips que poden comportar pèrdues financeres considerables a les empreses. Posteriorment, els segments de SAI requereixen la utilització d’un sistema de bateries fiable i provat.

Bateria SMF
Bateria de liti (Li):
Tots l’utilitzem en dispositius portàtils com ara telèfons mòbils, ordinadors portàtils o eines elèctriques. La bateria de liti ha estat un dels majors assoliments en energia portàtil en l'última dècada amb l'ús de bateries de liti que hem pogut passar del mòbil en blanc i negre als mòbils de color amb funcions addicionals com GPS, alertes de correu electrònic, etc. dispositius potencials de densitat d'energia per a capacitats més altes. I bateries d’autodescàrrega relativament baixes. També les cel·les especials poden proporcionar un corrent molt alt a aplicacions com eines elèctriques.

Bateria Li
Bateria de níquel cadmi (Nicd):
Les bateries de níquel-cadmi tenen l’avantatge de recarregar-se moltes vegades i tenen un potencial relativament constant durant la descàrrega i tenen una capacitat de resistència més elèctrica i física. Aquesta bateria utilitza òxid de níquel per al càtode, un compost de cadmi per a ànode i solució d’hidròxid de potassi com a electròlit.

Quan la bateria es carrega, la composició química del càtode es transforma i l’hidròxid de níquel canvia a NIOOH. A l’ànode, la formació d’ions de cadmi té lloc a partir de l’hidròxid de cadmi. Quan la bateria es descarrega, el cadmi reacciona amb NiOOH per formar hidròxid de níquel i hidròxid de cadmi.
Cd + 2H2O + 2NiOOH -> 2Ni (OH) 2 + Cd (OH) 2
Bateria de plom àcid:
Les bateries de plom àcid s’utilitzen àmpliament en automòbils, inversors, sistemes d’alimentació auxiliars, etc. A diferència de les bateries tubulars i sense manteniment, les bateries de plom àcid requereixen una cura i manteniment adequats per prolongar-ne la vida. La bateria de plom àcid consisteix en una sèrie de plaques mantingudes immerses en una solució d’àcid sulfúric. Les plaques tenen reixes sobre les quals s’enganxa el material actiu. Les plaques es divideixen en plaques positives i negatives. Les plaques positives mantenen el plom pur com a material actiu mentre l’òxid de plom s’uneix a les plaques negatives.

Bateria de plom àcid
Una bateria completament carregada pot descarregar el seu corrent quan es connecta a una càrrega. Durant el procés de descàrrega, l'àcid sulfúric es combina amb els materials actius de les plaques positives i negatives, donant lloc a la formació de sulfat de plom. L’aigua és el pas més important per mantenir una bateria de plom àcid. La freqüència de l’aigua depèn de l’ús, del mètode de càrrega i de la temperatura de funcionament. Durant el procés, els àtoms d’hidrogen de l’àcid sulfúric reaccionen amb l’oxigen per formar aigua.
Això resulta en l'alliberament d'electrons de les plaques positives que seran acceptades per les plaques negatives. Això condueix a la formació d’un potencial elèctric a través de la bateria. L'electròlit de la bateria de plom àcid és una barreja d'àcid sulfúric i aigua que té una gravetat específica. La gravetat específica és el pes de la barreja àcid-aigua en comparació amb el mateix volum d’aigua. La gravetat específica de l’aigua lliure d’ions purs és d’1.
Les bateries de plom-àcid proporcionen el millor valor per a la potència i l’energia per quilowatt-hora, tenen un cicle de vida més llarg i un gran avantatge ambiental, ja que es reciclen a un ritme extraordinàriament alt. Cap altra substància química pot tocar la infraestructura que existeix per recollir, transportar i reciclar bateries de plom-àcid.
Juntament amb aquest article, es discuteix la bateria de ions de liti amb els seus avantatges i desavantatges.
Funcionament de la bateria de ions de liti

Les bateries de liti-ion ara són populars en la majoria de dispositius electrònics portàtils com ara telèfons mòbils, portàtils, càmeres digitals, etc. a causa de la seva eficiència energètica duradora. Aquestes són les bateries recarregables més populars amb avantatges com la millor densitat d’energia, pèrdua de càrrega insignificant i sense efecte de memòria. La bateria Li-Ion utilitza ions de liti com a portadors de càrrega que es mouen de l’elèctrode negatiu a l’elèctrode positiu durant la descàrrega i tornen a l’hora de carregar-se. Durant la càrrega, el corrent extern del carregador aplica una sobretensió que la de la bateria. Això obliga el corrent a passar en sentit invers de l'elèctrode positiu al negatiu on els ions de liti s'incrusten al material de l'elèctrode porós mitjançant un procés anomenat intercalació. Els ions de Li passen per l'electròlit no aquós i un diafragma separador. El material de l'elèctrode és compost de liti intercalat.
L’elèctrode negatiu de la bateria de ions de li està format per carboni i l’elèctrode positiu és un òxid de metall. El material més utilitzat en l'elèctrode negatiu és el grafit, mentre que en l'elèctrode positiu pot ser òxid de liti cobalt, fosfat d'ions de liti o òxid de manganès de liti. La sal de liti d’un dissolvent orgànic s’utilitza com a electròlit. L’electròlit sol ser una barreja de carbonats orgànics com el carbonat d’etilè o el carbonat de dietil que contenen ions de liti. L’electròlit utilitza sals d’anions com fosfat de fluor de liti hexa, arsenat de liti hexa fluoro monohidrat, liti per clorat, borat de fluor de liti hexa, etc. El liti pur reacciona amb aigua amb força per formar ions hidròxid de liti i hidrogen. Per tant, l’electròlit utilitzat és un dissolvent orgànic no aquós. El paper electroquímic de la càrrega dels elèctrodes entre ànode i càtode depèn de la direcció del flux de corrent.

Reacció de la bateria d’ió li
A la bateria Li-Ion, tots dos elèctrodes poden acceptar i alliberar ions de liti. Durant el procés d’intercalació, els ions de liti es mouen a l’elèctrode. Durant el procés invers anomenat intercalació, els ions de liti es retrocedeixen. Durant la descàrrega, els ions de liti positius seran extrets dels elèctrodes negatius i inserits a l’elèctrode positiu. Durant el procés de càrrega, es produeix el moviment invers dels ions de liti.
Avantatges de la bateria de ions de liti:
Les bateries de ions de liti superen les bateries NiCd i altres bateries secundàries. Alguns dels avantatges són
- Pes lleuger en comparació amb altres bateries de mida similar
- Disponible en diferents formes, inclosa la forma plana
- Alt voltatge de circuit obert que augmenta la transferència de potència a baix corrent
- Falta d’efecte de memòria.
- Taxa d’autodescàrrega molt baixa del 5-10% al mes. La descàrrega automàtica és al voltant del 30% en bateries NiCd i NiMh.
- Bateria ecològica sense liti metàl·lic gratuït
Però juntament amb els avantatges, com altres bateries, la bateria de ions de Li també presenta alguns desavantatges.
Inconvenients de la bateria de ions de li:
- Els dipòsits a l'interior de l'electròlit amb el pas del temps inhibiran el flux de càrrega. Això augmenta la resistència interna de la bateria i disminueix gradualment la capacitat de la cèl·lula per lliurar corrent.
- Una càrrega elevada i una temperatura elevada poden provocar pèrdues de capacitat
- Quan es sobreescalfa, la bateria de ions de Li pot patir una fugida tèrmica i la ruptura de la cèl·lula.
- La descàrrega profunda pot provocar un curtcircuit de la bateria d’ió Li. Per evitar-ho, algunes marques tenen circuits interns d’aturada que apaguen la bateria quan la seva tensió és superior al nivell segur de 3 a 4,2 volts. En aquest cas, quan la bateria no s’utilitzi durant molt de temps, els circuits interns consumiran energia i esgotaran la bateria per sota del voltatge d’aturada. Per tant, per carregar aquestes bateries no són útils els carregadors normals.